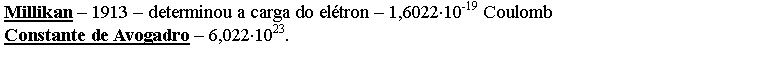CEFETES |
|
ELETRÓLISE – DECOMPOSIÇÃO PELA CORRENTE ELÉTRICA Reação de oxi-redução que é provocada pela corrente elétrica.
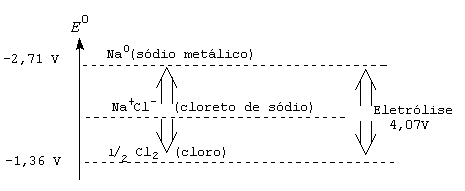
ELETRÓLISE ÍGNEA – ELETRÓLITO FUNDIDO – NaCl a 808 oC.
Passando corrente elétrica contínua através de uma célula eletrolítica: No pólo (-) Catodo Þ Na+ + e ® Na0 E0 = -2,71 volts No pólo (+) Anodo Þ Cl- ® ½ Cl2 + e E0 = -1,36 volts Reação Global Þ Na+Cl- Þ Na + ½ Cl2 DE = 4,07 volts
ELETRÓLISE EM SOLUÇÃO AQUOSA – ELETRODOS INERTES |
ELETRÓLISE EM SOLUÇÃO AQUOSA – ELETRODOS INERTES
ELETRÓLISE EM SOLUÇÃO AQUOSA DO NaCl |
|
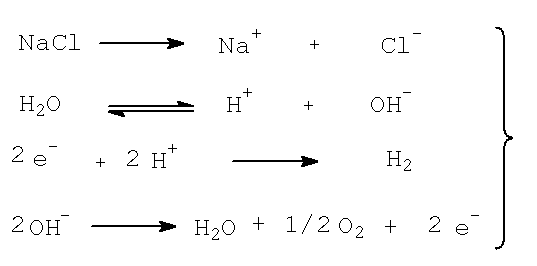
NaCl ® Na+ + Cl-. e H2O ® H+ + OH-. |
VERIFICAÇÃO EXPERIMENTAL
No ANODO: deverá ocorrer a OXIDAÇÃO: (perda de elétrons) 2Cl- ® Cl2 (gás) + 2e- (oxidação mais fácil) ou 2OH- ® H2O + ½O2 + 2e-. (oxidação difícil)
No CATODO: deverá ocorrer a REDUÇÃO: (ganho de elétrons) 2H+ + 2e- ® H2 (gás) (redução mais fácil) ou Na+ + e- ® Na0. (redução mais difícil)
SOLUÇÃO: NaCl + H2O ® Na+ + Cl- + H+ + OH-. No pólo (-) Redução: 2H+ + 2e- ® H2 (gás) . No pólo (+) Oxidação: 2Cl- ® Cl2 (gás) + 2e- . ________________________________________ Reação Global: NaCl + H2O ® 2 NaOH + H2 (gás) + Cl2 (gás).
1º Ex: Eletrólise de HCl em solução aquosa diluída, com eletrodos inertes. (eletrólise apenas do soluto) HCl + H2O ® H+ + OH- + Cl-
No pólo (-) Redução: 2H+ + 2e- ® H2 (gás) . No pólo (+) Oxidação: 2Cl- ® Cl2 (gás) + 2e- . Reação Global: HCl ® H2 (gás) + Cl2 (gás).
2º Ex: Eletrólise de H2SO4 em solução aquosa diluída, com eletrodos inertes. (eletrólise apenas do solvente)( 2H+ + SO42- permanecem ) H2SO4 + H2O ® 2H+ + SO42- + H+ + OH- No pólo (-) Redução: 2 H+ + 2e- ® H2 (gás) . No pólo (+) Oxidação: 2 OH- ® H2O + ½O2 (gás) + 2e-.
|
A ESTEQUIMETRIA DAS PILHAS E DA ELETRÓISE
Qual é a massa, em gramas, de NaOH produzidos na eletrólise de 234g de NaCl, em solução aquosa?
2 NaCl + 2 H2O à 2 NaOH + H2 + Cl2 . 2 × 58,5 g 2 × 40 g 234 g x x = 160 g de NaOH
Na pilha de Daniel, por exemplo temos: 1 Zn0 à Zn2+ + 2e- 1 mol 2 mols de elétrons Massa Molar (65,3 g) x elétrons (quantidade de eletricidade) i = Q/t ou Q = i×t .
i = intensidade de corrente elétrica (ampères – A) Q = quantidade de eletricidade (Coulomb – símbolo C) t = tempo (segundos – s)
1 elétron à 1,6022×10-19 Coulomb 1 mol de elétron (6,022×1023) à x= 96.484 Coulomb/mol @ 96.500 C
Exemplo: Qual é a quantidade de eletricidade obtida de uma pilha de Daniel pela oxidação de 0,2612 g de Zinco? (Massa Atômica do Zn = 65,3) E qual é a intensidade da corrente produzida, e sabendo-se que a pilha funcionou durante 25 minutos e 44 segundos? 1 Zn0 à Zn2+ + 2e- 1 mol 2 mols de elétrons Massa Molar (65,3 g) 2 × 96.500 C 0,2612 g Q Q = 772 C Lembrando: (25min × 60s + 44s) = 1.544 segundos: i = Q/t è i = 772 / 1.544 è i = 0,5 A. |